Ancora una volta, Eccellenza Medica sceglie di tornare dove il sapere nasce: nel confronto diretto con chi ogni giorno unisce sala operatoria, ricerca e insegnamento universitario.
Protagonista di questa intervista è nuovamente il Prof. Alberto Arezzo, Professore Ordinario di Chirurgia Generale per Chiara Fama all’Università di Torino e Presidente Eletto della European Association for Endoscopic Surgery. Una figura di riferimento nel panorama europeo della chirurgia mini-invasiva colorettale, capace di coniugare esperienza clinica, innovazione tecnologica e visione strategica sul futuro dell’oncologia chirurgica, che nel Giugno del 2028 organizzerà a Torino il Congresso Mondiale di Chirurgia Endoscopica.
A guidare il dialogo è Roberta Sestito, Manager di Eccellenza Medica, che con coerenza porta avanti una missione chiara: offrire una formazione di livello alto, autorevole, scientificamente rigorosa, rendendo accessibili temi complessi senza semplificarli. È una scelta culturale precisa: avvicinare pazienti e pubblico al pensiero dei grandi maestri della medicina, senza mediazioni superficiali.
In questo nuovo confronto si fa il punto su un ambito cruciale e in continua evoluzione: la chirurgia mini-invasiva nel trattamento del carcinoma del colon-retto. Tra personalizzazione delle cure, multidisciplinarietà, robotica, intelligenza artificiale e modelli predittivi, emerge una medicina sempre più orientata alla precisione e alla qualità di vita. Una medicina in cui la tecnica non è mai un automatismo, ma una scelta costruita attorno alle caratteristiche biologiche del tumore, alla storia clinica del paziente e al contesto organizzativo in cui si opera: perché oggi personalizzare significa integrare dati, esperienza e visione prospettica per offrire la strategia più appropriata, non semplicemente la più moderna.
Un confronto che non guarda solo a come si opera, ma a come si decide — perché oggi la vera frontiera dell’eccellenza non è la tecnica in sé, ma la capacità di scegliere la strategia giusta per ogni singolo paziente.
1. Professore, dopo la nostra precedente intervista, che si è trasformata in una vera e propria lezione universitaria, sono pronta a immergermi nuovamente in un tema complesso e in continua evoluzione. Nel solco della missione culturale di Eccellenza Medica, che mira ad avvicinare il grande sapere dei luminari ai pazienti e al pubblico, le chiedo oggi di aiutarci a fare il punto sullo stato dell’arte della chirurgia mini-invasiva nel trattamento del carcinoma del colon-retto.
"Oggi la chirurgia mini-invasiva nel colon-retto rappresenta un pilastro della pratica clinica nei centri che hanno sviluppato esperienza, volumi adeguati e percorsi assistenziali strutturati. La ragione di scegliere un approccio mini-invasivo non è l’estetica, ma il minore impatto sull’organismo: in particolare sul piano immunitario e, più in generale, sulla risposta allo stress chirurgico. A questo si aggiungono benefici concreti sulla qualità di vita, un rischio ridotto di ernie sugli accessi chirurgici, una minore probabilità di aderenze viscerali e, certamente, anche un vantaggio estetico.
Benché i vantaggi siano evidenti, va chiarito un punto essenziale: la mini-invasiva può essere presa in considerazione solo se consente di mantenere gli stessi obiettivi di radicalità e sicurezza oncologica. La tecnica non è mai un fine, ma uno strumento. E la scelta deve sempre essere guidata dall’appropriatezza clinica, dalla stadiazione, dalle caratteristiche del paziente e dalle competenze del team.
Negli ultimi anni, l’evoluzione si è mossa su più fronti: migliore qualità dell’imaging, strumenti più affidabili, robotica in casi selezionati, protocolli di recupero accelerato, e una crescente attenzione alla qualità misurabile dell’atto chirurgico. In parallelo, si è consolidata la cultura della personalizzazione: la tecnica migliore non è la più moderna in assoluto, ma quella più adatta a quel paziente, in quel momento, con quella malattia e in quel contesto organizzativo. In altre parole, siamo entrati nell’era della medicina di precisione: una medicina personalizzata sul paziente".
2. Medicina personalizzata, un connubio davvero significativo. Uno degli obiettivi di Eccellenza Medica è avvicinare i pazienti a percorsi di cura di alta specializzazione. In che modo la chirurgia mini-invasiva incide oggi sulla qualità di vita del paziente, oltre che sugli esiti oncologici?
"La qualità di vita oggi è un esito clinico a pieno titolo, non un elemento secondario. Nel colon, la mini-invasiva si associa spesso a minore dolore, recupero più rapido e riduzione di alcune complicanze della parete addominale. Ma è soprattutto nella chirurgia del retto che il tema della qualità di vita diventa centrale, perché qui l’obiettivo non è solo rimuovere la malattia, ma farlo preservando il più possibile la funzione.
Negli ultimi anni abbiamo assistito a un cambiamento importante: le moderne terapie perioperatorie e adiuvanti – incluse, in sottogruppi selezionati, strategie che incorporano anche l’immunoterapia – stanno aumentando la probabilità di risposte importanti al trattamento, fino ad aprire la strada, sempre più spesso, a percorsi meno demolitori. In questo contesto si collocano gli approcci transanali “organ-sparing”, cioè finalizzati a preservare l’organo quando oncologicamente appropriato: in pazienti selezionati, l’idea è trattare la lesione con procedure locali o transanali, evitando resezioni maggiori che, pur efficaci, possono compromettere la funzione.
Il vantaggio principale di questi approcci è che preservano in larga parte le funzioni del retto, con un impatto minimo sulla funzione di “ampolla” – cioè la capacità di serbatoio – e soprattutto riducendo il rischio di coinvolgere o lesionare strutture nervose che, se danneggiate, possono influenzare in modo significativo sia la continenza sia la funzione genito-urinaria. In altre parole, quando l’indicazione è corretta e la risposta oncologica lo consente, l’innovazione non è solo “operare con accessi più piccoli”, ma evitare la demolizione non necessaria, mantenendo qualità di vita, autonomia e funzioni che per il paziente sono decisive.
Naturalmente, questi percorsi richiedono criteri rigorosi di selezione, una stadiazione accurata, un team multidisciplinare e un follow-up molto strutturato. Ma la direzione è chiara: non solo curare, ma curare meglio, preservando funzione e persona".
3. A tal proposito, dal punto di vista clinico e chirurgico, quanto è diventata centrale la corretta selezione del paziente nel garantire l’efficacia e la sicurezza di un approccio mini-invasivo?
"È diventata centrale, perché la mini-invasiva è una scelta clinica, non un automatismo. La corretta selezione del paziente è ciò che permette di coniugare sicurezza, efficacia oncologica e qualità di vita: dipende dallo stadio, dalla sede del tumore, dalle caratteristiche anatomiche, dalle comorbidità, e dal percorso terapeutico complessivo, incluse eventuali terapie preoperatorie e la loro risposta. In pratica, l’obiettivo è evitare due errori opposti: rinunciare a un approccio vantaggioso quando è indicato, oppure forzare una strategia che aumenta il rischio o riduce l’appropriatezza oncologica.
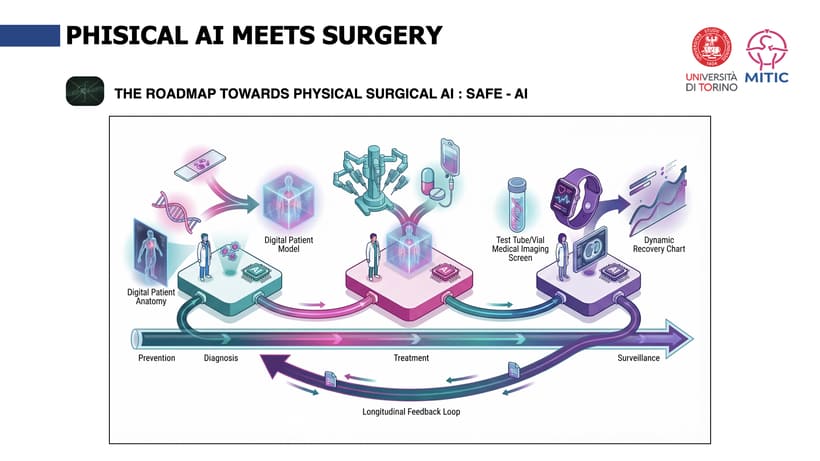
Oggi, però, stiamo entrando in una fase nuova, in cui la selezione non è più basata solo su esperienza e criteri clinici tradizionali, ma sempre di più su modelli integrati. In questo contesto si inserisce il concetto di “Digital Twin”: un Digital Twin oncologico, che integra informazioni del paziente e della malattia – fino ai dati biologici e genomici, quando disponibili – per aiutare a prevedere comportamento del tumore, risposta alle terapie e rischio di recidiva; e un Digital Twin chirurgico, che “replica” in modo dinamico lo scenario operatorio per supportare la pianificazione e l’esecuzione dell’intervento.
Su questi temi lavoriamo da anni in modo intenso al MITIC – centro di ricerca del Dipartimento di Scienze Chirurgiche (www.mitic-lab.org), con l’idea che la chirurgia del futuro debba diventare sempre più misurabile, predittiva e assistita. Stiamo inoltre attendendo con grande interesse un importante finanziamento europeo – nell’ordine di 17 milioni di euro – per sostenere un consorzio di oltre 30 partner: l’obiettivo è comprendere il ruolo di numerose variabili, dalla genomica fino ai dati intraoperatori, e trasformarle in strumenti concreti di supporto alla decisione.
Il punto cruciale è l’impatto pratico: un Digital Twin evoluto potrà aiutare non solo a stratificare meglio i pazienti, ma anche a ridurre l’inappropriatezza del trattamento chirurgico dal punto di vista oncologico. In prospettiva, potrà supportare il team direttamente in sala operatoria, ad esempio segnalando margini di resezione potenzialmente troppo vicini al tumore durante l’intervento, oppure suggerendo quando la linfadenectomia rischia di essere insufficiente rispetto agli standard oncologici. Non si tratta di “sostituire” il chirurgo, ma di ridurre la variabilità e prevenire errori o scelte non ottimali, migliorando sicurezza e appropriatezza".
4. La chirurgia colorettale contemporanea si inserisce sempre più all’interno di percorsi multidisciplinari. In che modo questo modello integrato contribuisce al miglioramento degli esiti complessivi del trattamento?
"Il modello multidisciplinare oggi è determinante perché consente di trasformare la complessità in una strategia coerente, personalizzata e realmente “guidata dai dati”. Da circa un anno ho la responsabilità di coordinare il lavoro del MDT (Multidisciplinary Team) della Città della Salute e della Scienza: ogni settimana convergono chirurghi di diverse specialità, oncologi, radiologi e radioterapisti, e abbiamo a disposizione anche figure chiave come nutrizionisti, anatomopatologi e altri specialisti.
In questo contesto, ogni caso viene esaminato in dettaglio: non ci limitiamo a “decidere un trattamento”, ma costruiamo un piano completo, strutturato come un vero e proprio algoritmo. In base alle risultanze dei diversi step concordati – stadiazione, risposta a eventuali terapie, rivalutazioni, fattori di rischio e fragilità – si propone al paziente l’opzione per lui più adatta. E qui c’è un aspetto essenziale: la medicina moderna deve offrire percorsi e scenari chiari, ma lasciare sempre al paziente una scelta consapevole tra opzioni diverse, spesso combinate, spiegandone benefici, rischi e implicazioni sulla qualità di vita.
Nel cancro del retto questo approccio è ancora più evidente, perché l’evoluzione degli schemi neoadiuvanti ha cambiato in modo sostanziale le possibilità terapeutiche. Nel MDT discutiamo regolarmente l’applicazione pratica delle evidenze emerse da grandi studi come RAPIDO, PRODIGE e OPRA, che hanno contribuito a ridefinire intensità e sequencing delle terapie preoperatorie e, di conseguenza, le strategie di preservazione d’organo nei pazienti selezionati.
La conseguenza è che, dopo la risposta al trattamento, anche la scelta chirurgica diventa più “su misura”: si può passare da un approccio di sola escissione locale transanale nei casi appropriati, a una Total Mesorectal Excision (TME) quando serve una radicalità standard, fino a procedure più estese, inclusa l’exenteratio nei casi localmente avanzati più complessi o recidivati, talvolta in pazienti giovani in cui l’obiettivo resta comunque massimizzare le chance di controllo di malattia.
In sintesi: il MDT non è una formalità organizzativa, ma il luogo in cui si costruisce la medicina di precisione “reale”, caso per caso, con un equilibrio continuo tra efficacia oncologica, qualità di vita e preferenze del paziente".
5. Professore, le chiedo: rispetto alla chirurgia tradizionale, quali sono oggi i principali vantaggi, ma anche i limiti, della chirurgia mini-invasiva nel trattamento del carcinoma del colon-retto?
"I vantaggi e i limiti della chirurgia mini-invasiva nel colon-retto oggi vanno letti distinguendo almeno tre grandi famiglie di approccio: laparoscopia, robotica laparoscopica e approcci transanali. Ognuna offre opportunità reali, ma anche vincoli specifici.
La laparoscopia è ormai una tecnologia matura e ampiamente consolidata. I benefici più noti sono il minor trauma di parete, spesso minor dolore post-operatorio, mobilizzazione più rapida, riduzione di alcune complicanze respiratorie e un recupero complessivamente più veloce. Dal punto di vista tecnico, l’ingrandimento e l’illuminazione migliorano la dissezione e la precisione, con potenziali ricadute sulla qualità dell’intervento quando eseguito in mani esperte. I limiti principali sono legati alla curva di apprendimento, alla complessità di alcuni scenari (pelvi stretta, obesità, chirurgia dopo radioterapia, reinterventi) e alla necessità di un contesto organizzativo capace di garantire standard elevati e gestione delle complicanze.
Gli approcci transanali hanno una logica diversa: non sono soltanto “un accesso alternativo”, ma spesso una strategia orientata alla preservazione d’organo o alla migliore gestione di procedure selezionate nel retto. In casi appropriati, la chirurgia transanale può consentire escissioni locali mirate con impatto funzionale minimo, o favorire un trattamento più “su misura” dopo una buona risposta alle terapie neoadiuvanti. I vantaggi potenziali sono evidenti soprattutto sul piano funzionale: ridurre l’estensione della resezione significa, in molti pazienti selezionati, ridurre il rischio di disfunzioni evacuative e genito-urinarie e preservare maggiormente la qualità di vita. Al tempo stesso, i limiti sono altrettanto chiari: serve una selezione rigorosa, una stadiazione accurata, un team con esperienza specifica e un follow-up strutturato. Inoltre, in alcune situazioni la complessità tecnica e i rischi intra/post-operatori possono aumentare se l’approccio viene utilizzato fuori indicazione o senza adeguata expertise.
La robotica laparoscopica (robot-assistita) rappresenta un’evoluzione tecnologica che può migliorare l’ergonomia dell’operatore, la manovrabilità degli strumenti e la precisione dei movimenti, con vantaggi potenziali soprattutto in anatomie complesse, come la pelvi profonda, oppure in procedure particolarmente delicate. Tuttavia, è importante essere molto chiari: ad oggi, finché non avremo una reale integrazione di sistemi di intelligenza artificiale e di supporto decisionale intraoperatorio, sarà spesso difficile dimostrare benefici clinici netti e generalizzabili per il paziente rispetto a una laparoscopia di alta qualità eseguita in centri esperti. La robotica offre certamente vantaggi tecnici e di comfort per il chirurgo, ma il punto cruciale per la medicina è l’outcome del paziente: complicanze, funzionalità, qualità oncologica, recupero, e sostenibilità.
In questa prospettiva, l’elemento che potrebbe davvero cambiare lo scenario non è il “braccio robotico” in sé, ma l’integrazione con strumenti intelligenti: AI applicata alla visione intraoperatoria, alla stima del rischio, alla guida dei piani di dissezione, al riconoscimento di strutture anatomiche e alla verifica in tempo reale di parametri oncologici e tecnici. Ed è importante sottolineare che queste applicazioni non sono esclusive della robotica: possono essere applicate anche alla laparoscopia tradizionale, rendendo l’intervento più sicuro e standardizzato indipendentemente dalla piattaforma.
In sintesi, la mini-invasiva non è “una tecnologia”, ma un insieme di approcci. Laparoscopia, transanale e robotica hanno spazi e indicazioni differenti: la chiave resta scegliere in modo appropriato, garantire expertise, e orientare l’innovazione verso ciò che conta davvero, cioè risultati migliori e più misurabili per il paziente".
6. Dal punto di vista della formazione, quanto è complessa la curva di apprendimento di queste tecniche e quanto è determinante l’esperienza maturata in centri ad alto volume?
"La curva di apprendimento è complessa, perché non riguarda solo “saper eseguire” una procedura, ma garantire risultati riproducibili in termini di radicalità oncologica, sicurezza, complicanze, conversioni, gestione del sanguinamento e qualità funzionale nel lungo periodo. In chirurgia colorettale, soprattutto nel retto, la difficoltà è amplificata dall’anatomia pelvica, dalla variabilità dei pazienti (obesità, precedenti chirurgici, radioterapia) e dal fatto che piccoli errori tecnici possono tradursi in differenze importanti per il paziente.
Per questo oggi la formazione non può più essere affidata solo all’apprendimento “sul campo”. La simulazione in laboratorio è diventata essenziale: consente di acquisire e consolidare gesti tecnici, coordinazione, sutura, gestione degli strumenti e strategie operative in un ambiente controllato, riducendo il rischio nella fase iniziale della curva. La simulazione permette anche un training più moderno: obiettivi chiari, metriche di performance, ripetizione, feedback strutturato e progressione per step. In altre parole, accelera l’apprendimento e, soprattutto, lo rende più sicuro.
L’esperienza maturata in centri ad alto volume resta determinante perché un centro non è soltanto una sala operatoria: è un ecosistema. Significa casistica sufficiente, team dedicato, protocolli perioperatori, radiologia e anatomia patologica esperte, riunioni multidisciplinari regolari, e un sistema di audit continuo degli esiti. In questi contesti, il chirurgo in formazione non impara solo “come si opera”, ma come si decide, come si gestisce la complicanza, come si seleziona il paziente e come si garantisce qualità in modo stabile nel tempo.
Quanto alla tecnologia, è verosimile che un vantaggio della chirurgia robotica, quando disponibile e inserita in un percorso formativo strutturato, sia proprio una curva di apprendimento più rapida per alcuni gesti: la stabilità dell’immagine, l’ergonomia, la maggiore libertà di movimento degli strumenti e la riduzione del tremore possono facilitare l’acquisizione di manovre complesse, soprattutto in spazi ristretti come la pelvi. Questo non elimina la necessità di esperienza clinica e giudizio chirurgico, ma può rendere più accessibile la ripetibilità del gesto tecnico in una fase più precoce dell’apprendimento.
In sintesi: la formazione moderna è un percorso integrato fatto di simulazione, mentoring, step progressivi, audit e centralizzazione nei centri ad alto volume. E la tecnologia, inclusa la robotica, può aiutare, ma solo se inserita in una cultura della qualità e della sicurezza che rimane il vero discriminante".
7. Alla luce delle evidenze scientifiche più recenti, quali aspetti della chirurgia mini-invasiva del colon-retto possono considerarsi consolidati e quali, invece, restano ancora oggetto di studio e confronto scientifico?
"È consolidato che, in mani esperte e con corretta indicazione, la chirurgia mini-invasiva può garantire standard oncologici adeguati e, al tempo stesso, vantaggi sul decorso post-operatorio in molte procedure del colon e in una parte significativa anche del retto. È consolidata anche l’importanza della standardizzazione dei percorsi, perché oggi il risultato non dipende solo dal gesto tecnico, ma dall’intero processo: ottimizzazione preoperatoria, gestione perioperatoria, protocolli di recupero accelerato, riduzione delle complicanze e ritorno rapido alla funzione. In altre parole, ciò che è davvero “maturato” è un modello: tecnica mini-invasiva + team esperto + percorso strutturato.
Accanto a questo, però, restano aree in cui il confronto scientifico è ancora molto vivo. La prima riguarda il valore aggiunto delle diverse piattaforme, in particolare della robotica: non tanto sul piano della fattibilità tecnica, quanto sulla capacità di dimostrare benefici clinici netti e sostenibilità rispetto a una laparoscopia di alta qualità. La seconda area è quella della preservazione d’organo, soprattutto nel retto: grazie a schemi neoadiuvanti sempre più efficaci e a un follow-up più accurato, cresce l’interesse per strategie selezionate che riducano la demolizione e puntino a preservare funzione e qualità di vita, ma servono criteri rigorosi e dati solidi sulla sicurezza oncologica nel lungo periodo. La terza area è la definizione precisa dei sottogruppi: chi beneficia davvero di un approccio rispetto a un altro, e in quali condizioni anatomiche, biologiche e cliniche. Qui la ricerca sta andando verso modelli predittivi, registri, audit e strumenti digitali per ridurre variabilità e rendere le scelte sempre più personalizzate.
Ma c’è un punto che rappresenta l’orizzonte più ambizioso — e in parte ancora lontano — dell’evoluzione oncologica: arrivare a terapie mediche che non siano solo un supporto fondamentale prima e dopo la chirurgia, ma che in una quota crescente di casi possano sostituire la chirurgia stessa. È un cambio di paradigma: dalla chirurgia come asse portante alla chirurgia come opzione selettiva, riservata ai casi che davvero ne hanno bisogno. Un esempio storico molto chiaro è quello dei tumori dell’ano, per i quali da circa cinquant’anni il trattamento standard è prevalentemente non chirurgico, basato su chemioradioterapia, con la chirurgia relegata a situazioni selezionate di salvataggio.
Nel colon-retto non siamo ancora a quel punto, perché biologia, anatomia e storia naturale della malattia sono diverse. Tuttavia, la direzione della ricerca — tra ottimizzazione delle terapie sistemiche, farmaci mirati, immunoterapia in sottogruppi selezionati e strategie di risposta-guidata — va anche in quella direzione: curare in modo sempre più efficace, ma con la minore “invasività globale” possibile, fino a ridurre, quando oncologicamente sicuro, il bisogno di interventi demolitori. In sintesi: il consolidato riguarda la qualità e la sicurezza della mini-invasiva; la frontiera riguarda la personalizzazione estrema e, in prospettiva, la possibilità di “curare senza tagliare” almeno una parte dei pazienti".
8. Concludiamo con uno sguardo al futuro: quali innovazioni o sviluppi ritiene più promettenti per ridefinire i confini della tecnica, e quali competenze e approcci ritiene fondamentali perché i giovani chirurghi possano affrontare con successo le sfide che li attendono?
"Le innovazioni più promettenti sono quelle che aumentano precisione, prevedibilità e sicurezza, non solo “l’effetto tecnologico”. In questo senso, la robotica e l’intelligenza artificiale stanno aprendo una nuova fase: piattaforme chirurgiche più integrate, imaging intraoperatorio più informativo, e strumenti digitali capaci di supportare pianificazione, standardizzazione e valutazione oggettiva della qualità tecnica. L’AI potrà contribuire soprattutto nel rendere misurabili processi che oggi dipendono troppo dall’esperienza individuale, riducendo variabilità e migliorando la riproducibilità dei risultati.
Il punto di svolta, però, sarà l’evoluzione da una robotica teleoperata a una robotica con elementi di task autonomy, cioè autonomia su compiti specifici e ben delimitati. Parliamo, ad esempio, di applicazioni come la sutura automatizzata: non un robot che “opera da solo”, ma un sistema capace di eseguire in modo controllato e ripetibile alcune fasi tecniche, sotto supervisione del chirurgo. Questo approccio può aumentare precisione, ridurre tempi e rendere più standardizzabili gesti complessi. È una direzione su cui stiamo lavorando intensamente al MITIC, con l’obiettivo di arrivare entro la fine dell’anno almeno a una dimostrazione solida in modelli di laboratorio.
Naturalmente, qui va ribadito un principio non negoziabile: human-in-the-loop. La responsabilità clinica resta umana e la tecnologia deve essere un supporto, non un sostituto. La task autonomy ha senso proprio perché riguarda compiti circoscritti, verificabili e controllabili, in cui il chirurgo rimane sempre in grado di intervenire, correggere, interrompere e decidere.
Un secondo fronte, forse ancora più rilevante per il paziente, è la prevenzione degli errori — non solo tecnici, ma anche oncologici. L’integrazione di visione computazionale, modelli predittivi e dati intraoperatori potrà aiutare a prevenire situazioni che oggi dipendono molto dall’esperienza del singolo operatore. In prospettiva, sistemi intelligenti potranno supportare il team segnalando, durante l’intervento, margini di resezione potenzialmente troppo vicini al tumore, una linfadenectomia insufficiente, o criticità anatomiche che aumentano il rischio di complicanze. Questo non significa automatizzare la decisione, ma aggiungere un livello di controllo e consapevolezza, riducendo la probabilità di inappropriatezza oncologica o di errori evitabili.
Per i giovani chirurghi, quindi, le competenze fondamentali saranno doppie. Da un lato resta imprescindibile la base: anatomia, tecnica, gestione delle complicanze, cultura oncologica e giudizio clinico. Dall’altro diventa sempre più centrale la capacità di lavorare in team multidisciplinari, leggere i dati, partecipare a audit e registri, e sviluppare un approccio critico alla tecnologia: saper distinguere ciò che è realmente utile per il paziente da ciò che è solo “innovazione di facciata”.
Il futuro premierà chi saprà unire precisione chirurgica, pensiero scientifico e responsabilità clinica, utilizzando robotica e AI per un obiettivo molto concreto: più sicurezza, meno variabilità e meno errori — tecnici e oncologici — a beneficio del paziente".

